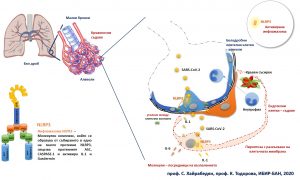
Проучвания, стартирали през 2010 г. на учени от Института по биология и имунология на размножаването на Българската академия на науките (ИБИР-БАН), ги насочват към това, че именно свръхреакция на един сложен белтъчен комплекс, наречен инфламазома NLRP3 е в основата на тежките усложнения при COVID-19. Инфламазомата е молекулен сензор в клетките, който реагира на среща с патоген и/или клетъчна увреда, в резултат на което се отделят сигнали за възпаление, и може да настъпи и особен вид клетъчна смърт – пироптоза. При това клетките се разпукват и освобождават огромно количество сигнали за възпаление и опасност, на които реагират съседни клетки от тъканите, както и клетки на имунната система. Нормално, мъртвите клетки се изяждат от клетки на имунната система, каквито са макрофагите, но в случая сигналите пътуват много по-надалеч.
Инфламазомата е част от механизмите на вродения имунен отговор и дълги години се считаше, че присъства само в имунните клетки. Наскоро стана ясно, че такъв комплекс има и в други клетки, като тези в дихателните пътища, както и клетките, изграждащи кръвоносните съдове. Проф. д-р Сорен Хайрабедян и проф. Красимира Тодорова от ИБИР-БАН показват през 2016 г. за пръв път в литературата (Nature Sci Reports 2016) възможност тази инфламазома да се активира дори в епителни клетки, създаващи имунотолерантна среда, което да доведе до сигнали за възпаление и клетъчна смърт. Две години по-късно тези данни бяха потвърдени и при пациенти от екип, ръководен от Университета Лудвиг Максимилиан към Макс Планк (Reproduction, 2018).
Първите данни за тежка дихателна недостатъчност в резултат на т. нар. „цитокинова буря“ и сепсис ни наведоха на мисълта, че именно този сложен молекулен комплекс може да има връзка с това, тъй като блокирането на инфламазомата в експериментални модели на сепсис спира процеса, посочват учените. При по-висок вирусен товар или при наследствено предразположение към по-силна от нормалната реакция, инфламазомата в епителните клетки на белия дроб, както и в клетките на малките съдове може да се активира. Странното е, че в белодробните клетки това може да доведе до отделяне на възпалителни сигнали, но едновременно с това се заздравява контактът помежду им. При прилежащите микро-съдове обаче ефектът може да е драстичен – значителна клетъчна смърт, с разпукването им, което да причини нарушения в газовата обмяна или в кръвотока. Съвсем нови научни статии от 20-23 април 2020 г. потвърждават това при пациентите с COVID-19, показвайки тежки феномени на кръвосъсирване в малките съдове.
Инфламазомите са свързани с различни заболявания, в които участва имунната система, вкл. диабет, множествена склероза, хроничен улцеративен колит, ревматоиден артрит, подагра и сепсис. Модели на сепсис се прекъсват с блокиране на инфламазомата с инхибитор. Хлорокинът, който е изследван като потенциално средство срещу COVID-19 и се дава при болни с ревматоиден артрит и лупус, е директен блокер на същата инфламазома и може да потисне модел на сепсис. Най-често се цитират механизмите му на действие, установени през 80-90 год. на миналия век, тъй като инфламазомите са открити едва наскоро.
Хипотезата на двамата учени от ИБИР би могла да обясни както случаите при млади хора – свръх-активация на инфламазомите, така и по-тежко протичане при хора с високо кръвно, диабет, атеросклероза, тъй като при последните първо се засягат именно клетките на малките съдове. Важно е са се отбележи, че инфламазомите участват в самата патогенеза на диабета и атеросклерозата и вече са активни. Блокирането на инфламазомите води до спиране на модели на възпаление на съдовете при болест на Кавасаки, протичаща с възпаление на коронарните съдове и висока температура.